La administración de H2 reduce las deformidades del comportamiento en la descendencia en un modelo de activación inmune materna (MIA)
Introducción:
La administración de H2, en varios estudios, ha demostrado ser beneficiosa para el bienestar de la salud. El objetivo del estudio fue comprender e investigar los resultados a largo plazo de la descendencia en el modelo de activación inmune materna (MIA) inducida por lipopolisacáridos (LPS) y el impacto de la administración materna de hidrógeno molecular.
Los investigadores habían demostrado anteriormente en el modelo de ratón MIA los efectos de la administración de H2. La administración de hidrógeno H2 redujo el daño oxidativo y la neuroinflamación, las citoquinas proinflamatorias y la activación microglial en el cerebro fetal.
A través de pruebas como Y-maze, tres cámaras e inhibición prepulso (PPT) en las 3 o 4 semanas posnatales, los investigadores han evaluado las implicaciones de la administración de H2 en la pérdida de memoria a corto plazo, la sociabilidad y la novedad social, y la activación sensoriomotora. . Los oligodendrocitos y el número de neuronas también se analizarán a las 5 semanas posnatales mediante análisis inmunohistoquímico. La administración materna de H2 redujo considerablemente las anomalías inducidas por LPS.
El efecto de la administración de H2 sobre las anomalías del comportamiento de la descendencia: antecedentes
La asociación entre la activación inmune materna (MIA) y los posteriores trastornos del desarrollo neurológico en la descendencia se ha vuelto cada vez más reconocida, con evidencia epidemiológica y hallazgos de investigaciones en varios modelos animales. La activación inmune materna contra infecciones virales o bacterianas influye en el sistema nervioso central (SNC) fetal en desarrollo y aumenta el riesgo de esquizofrenia y trastorno del espectro autista (TEA) en el futuro. Se ha sugerido que la MIA afecta sustancialmente el desarrollo microglial, y la alteración microglial interrumpe la neurogénesis, la migración neuronal y la mielinización, lo que conduce a las consiguientes deficiencias en la función cerebral de la descendencia. Según estos hallazgos, se cree que la activación inmune materna es un factor desencadenante de la enfermedad.1. También se ha informado que la MIA y la neuroinflamación fetal inducida por MIA estimulan la generación de especies reactivas de oxígeno (ROS) y alteraciones en la producción de citoquinas proinflamatorias en el cerebro fetal. Se informa que estos cambios conducen a la muerte o disfunción directa e indirecta de las células neuronales y oligodendrocitos, que se consideran los principales objetivos de la lesión cerebral fetal.
Anteriormente hemos sugerido que la administración materna de hidrógeno molecular (H2) desempeña un papel neuroprotector en el cerebro fetal contra las lesiones causadas por el estrés oxidativo y la inflamación.
Ohsawa explicó los efectos del H2 como antioxidante en su descubrimiento. Según Ohsawa, «el H2 es un antioxidante que neutraliza selectivamente los radicales hidroxilo (•OH) y protege el cerebro de lesiones».
Numerosos estudios sucesivos han explorado los efectos terapéuticos y preventivos del uso de H2 e indicaron que el H2 tiene otras propiedades, incluidos efectos antiinflamatorios y antiapoptóticos. La seguridad y algunos beneficios futuristas del H2 ya han sido probados y aceptados en modelos animales y en pacientes que padecen la enfermedad de Parkinson, diabetes mellitus y deterioro cognitivo leve.
Sin embargo, hasta la fecha no se han realizado ensayos controlados aleatorios de gran tamaño. Recientemente, los investigadores demostraron que la administración de H2 a madres de ratones preñadas aumentó significativamente la concentración de H2 en el cerebro fetal, a través de la interfaz materno-fetal, en un modelo de ratón de MIA inducida por lipopolisacáridos (LPS). El daño fetal en este modelo MIA y el efecto de la administración materna de H2 sobre este daño se pueden resumir de la siguiente manera:
Problemas:
- Los fetos MIA tienen una alta tasa de mortalidad.
- Los fetos MIA tienen una alta tasa de mortalidad.
Después de la administración de H2:
- Reducción de los resultados adversos antes mencionados mediante la administración materna de H2.
Esto demostró el efecto protector de la administración materna de H2 sobre los resultados a corto plazo en la descendencia MIA. Sin embargo, aún no se han investigado los efectos a largo plazo de la descendencia superviviente.
El estudio actual utilizó exámenes histológicos y de comportamiento para investigar los efectos a largo plazo y la eficacia de la administración de H2 en madres preñadas, así como su resultado neurológico en el modelo de ratón MIA. Los astrocitos, la población celular más abundante del SNC, desempeñan un papel fundamental en el desarrollo del cerebro. Sin embargo, cuando las atrocidades se exponen a citocinas de origen materno en la Activación Inmunitaria Materna, producen varias citocinas que conducen a alteraciones del desarrollo neurológico. Además, la activación de los astrocitos es una razón conocida para la prolongación del daño cerebral y contribuye a la formación de cicatrices gliales que limitan la plasticidad neuronal. Así, en el presente estudio, también se investigó in vivo e in vitro la activación inmune materna y su modificación mediante la administración de H2.
Resultados
Los investigadores, en su artículo publicado en Scientific Reports, encontraron los siguientes resultados:
Los resultados se citan del trabajo de investigación para garantizar la autenticidad y precisión de la comunicación de la información.
La administración materna de H2 restableció el crecimiento de la descendencia.
Investigamos el crecimiento posnatal, que podría estar relacionado con los resultados neurológicos. Desde el día postnatal (P) 6 al P10, el crecimiento de la descendencia se retrasó significativamente en el grupo de LPS en comparación con el grupo de control (p <0,05). Aunque no se observaron diferencias significativas entre los grupos LPS y LPS + HW, la administración materna de agua con hidrógeno (HW) restableció el crecimiento de la descendencia al nivel de control.
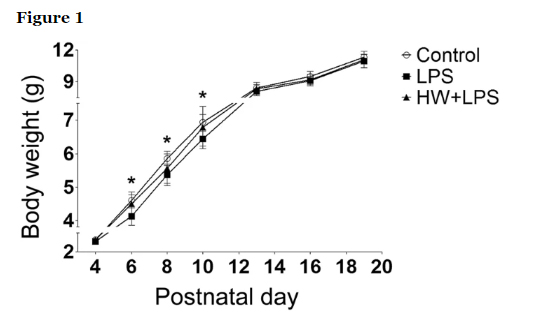
Imagen de cortesía – https://pubmed.ncbi.nlm.nih.gov/29907804/
Crecimiento de la descendencia evidenciado por el peso corporal (n = 17–22; Control, 17 crías/5 madres; LPS, 22 crías/5 madres; HW + LPS, 19 crías/5 madres); *p <0,05, grupo LPS versus grupo control, mediante ANOVA de medidas repetidas bidireccionales con prueba post-hoc de Bonferroni. LPS, lipopolisacárido; HW, agua hidrogenada.
La administración materna de H2 atenuó los déficits de comportamiento inducidos por la exposición al LPS.
Dado que se considera que la MIA causa anomalías de comportamiento en la descendencia, incluido el comportamiento similar al TEA/esquizofrenia, posteriormente evaluamos los efectos del LPS y la administración materna de HW sobre la memoria a corto plazo, la sociabilidad, la novedad social y la activación sensoriomotora. Según la siguiente figura, la alternancia espontánea se redujo notablemente en el grupo de LPS que en el grupo de control (p <0,001) en la prueba del laberinto Y, lo que indica un deterioro de la memoria a corto plazo. El tratamiento con H2 atenuó significativamente el deterioro de la memoria a corto plazo inducido por LPS (p <0,05). No hubo diferencias en el número total de entradas al brazo entre los tres grupos (Control, 24,0 ± 1,3; LPS, 22,6 ± 0,61; HW + LPS, 22,7 ± 0,91).
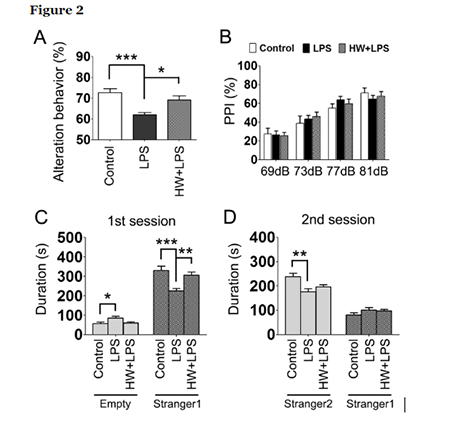
Imagen de cortesía – https://pubmed.ncbi.nlm.nih.gov/29907804/
Para investigar los comportamientos sociales, evaluamos la sociabilidad y la preferencia por la novedad social en la prueba social de tres cámaras. Durante la fase de habituación, los ratones de cada grupo pasaron la misma cantidad de tiempo explorando ambos compartimentos, sin preferencia sesgada por ninguno de los cilindros vacíos. Durante la fase de sociabilidad, los ratones de cada grupo prefirieron pasar más tiempo en la cámara que contenía un ratón desconocido (extraño 1) en comparación con la cámara vacía opuesta. Sin embargo, la descendencia tratada con LPS se acercó a la cámara que contenía al extraño 1 significativamente menos frecuentemente que los grupos control y HW + LPS (p <0,001 y p <0,01, respectivamente; Fig. 2C). Durante la fase de preferencia por la novedad social, los ratones de cada grupo mostraron una preferencia significativa por el ratón nuevo y desconocido (extraño 2) sobre el ratón anterior, ahora familiar (extraño 1). Sin embargo, la descendencia tratada con LPS se acercó a la cámara que contenía al extraño 2 significativamente menos frecuentemente que el grupo de control (p <0.01; Fig. 2D). No hubo diferencias entre los grupos LPS y HW + LPS, aunque se detectó una tendencia hacia la atenuación de la reducción inducida por LPS en la preferencia por la novedad social en el grupo HW + LPS.
La prueba de inhibición previa al pulso (PPI) se realizó para evaluar la integración sensoriomotora midiendo la respuesta de sobresalto a los pulsos acústicos administrados; sin embargo, no se detectaron diferencias significativas entre los grupos (Fig. 2B).
La administración materna de H2 atenuó la pérdida neuronal inducida por LPS.
En nuestra investigación anterior, la microglía activada se acumuló principalmente en un área de asociación temporal, 8 h después del insulto de LPS. Las neuronas de esta zona se han relacionado con déficits de sociabilidad. Además, es bien conocida la asociación entre el autismo y la amígdala, especialmente en la amígdala lateral. Además, la amígdala interactúa con el hipocampo en relación con la memoria. Con base en esos hallazgos, posteriormente realizamos tinción de Nissl y evaluamos la cantidad de neuronas en la amígdala, la corteza cerebral y el hipocampo para investigar las regiones del cerebro relacionadas con los déficits de comportamiento inducidos por la exposición al LPS. Los resultados cuantitativos revelaron reducciones significativas en el número de neuronas en la amígdala y la corteza cerebral en la descendencia tratada con LPS que en el grupo de control (p <0,001 yp <0,001, respectivamente; Fig. 3A, paneles a, b, d, e y 3B), pero no en el hipocampo. La pérdida neuronal inducida por LPS en la amígdala y la corteza cerebral mejoró en el grupo HW + LPS que en el grupo LPS (p <0,05 y p <0,05, respectivamente; Fig. 3A, paneles c, f y 3B).
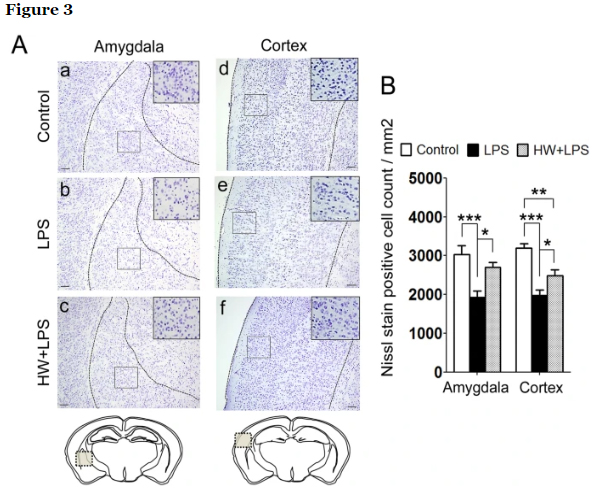
Imagen de cortesía – https://pubmed.ncbi.nlm.nih.gov/29907804/
La administración materna de H2 atenuó la pérdida de oligodendrocitos inducida por LPS y suprimió la activación astrocítica.
Los mecanismos fisiopatológicos de la lesión cerebral debida a MIA no se comprenden completamente. Sin embargo, durante la inflamación prenatal, se informó que los astrocitos activados dañaban potencialmente las neuronas y los oligodendrocitos, lo que daría lugar a comportamientos anormales en el futuro. El número de oligodendrocitos se evaluó utilizando Olig2, un factor de transcripción implicado en la diferenciación de células del linaje oligodendroglial, y un marcador de oligodendrocitos maduros. En comparación con el grupo de control, el número de células positivas para Olig2 se redujo claramente en la sustancia blanca, la amígdala y la corteza cerebral en el grupo de LPS (p 0,01, p 0,05 y p 0,05, respectivamente; Fig. 4A, paneles a, b, d, e, g, h y 4C). El tratamiento con H2 bloqueó completamente la disminución inducida por LPS de células positivas para Olig2 en las tres regiones (p 0,01, p 0,05 y p 0,01, respectivamente; Fig. 4A, paneles c, f, i y 4C).
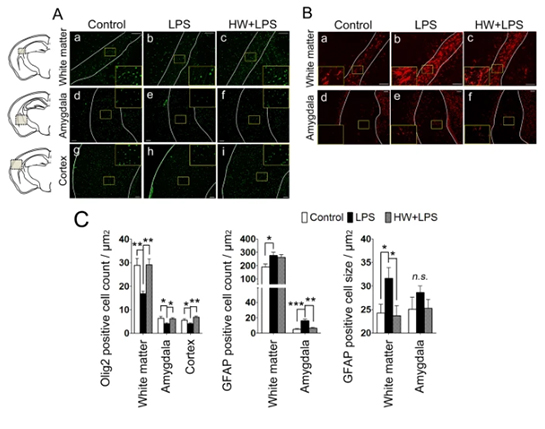
Imagen de cortesía – https://pubmed.ncbi.nlm.nih.gov/29907804/
Las características distintivas de la activación astrocítica incluyen el desarrollo de una morfología hipertrófica con menos procesos y la regulación positiva de las proteínas de los filamentos intermedios, en particular la proteína ácida fibrilar glial (GFAP). En el grupo de control, se detectaron algunas células positivas para GFAP, la mayoría de las cuales estaban en reposo (Fig. 4B, paneles a, d). En comparación con el grupo de control, se observó un número significativamente mayor de astrocitos activados, caracterizados por un soma grande y menos procesos (obteniendo así una forma más redondeada), en la sustancia blanca y la amígdala de la descendencia tratada con LPS (p <0,05 y p <0,001, respectivamente; 4B, paneles b, e y 4D). Para evaluar el soma hipertrófico, también se cuantificó el tamaño celular de los astrocitos calculando la relación entre el área inmunoteñida de GFAP y el número de células positivas para GFAP. Se observó un soma más grande en la sustancia blanca de los cerebros de ratones expuestos a LPS (p <0,05; Fig. 4B, paneles by 4E). Aunque el número de células positivas para GFAP no cambió después del tratamiento con H2, el tamaño de las células positivas para GFAP se redujo significativamente en la sustancia blanca (p < 0,05; Fig. 4B, paneles cy 4E), lo que indica un número reducido de astrocitos reactivos mediante el tratamiento con H2. En la amígdala, el número de astrocitos positivos para GFAP en el grupo HW + LPS disminuyó significativamente (p < 0,01; Fig. 4B, paneles f y 4D).
El tratamiento con H2 suprimió la activación inducida por LPS en astrocitos cultivados primarios.
Debido a que la sobreactivación de las células inmunes, incluidos los astrocitos, podría dañar las neuronas con la sobreproducción de citocinas proinflamatorias, investigamos el efecto antiinflamatorio del H2 en los astrocitos utilizando astrocitos cultivados primarios. Como se muestra en la Fig. 5, la estimulación de los astrocitos con LPS durante tres horas aumentó el factor de necrosis tumoral α (TNF-α) (p <0,001), la interleucina (IL)-1β (p <0,001) y la IL-6 (p < 0,001) expresión de ARNm. Estos aumentos en la expresión de TNF-α (p <0,01), IL-1β (p <0,001) e IL-6 (p <0,05) se atenuaron significativamente con el tratamiento con H2. 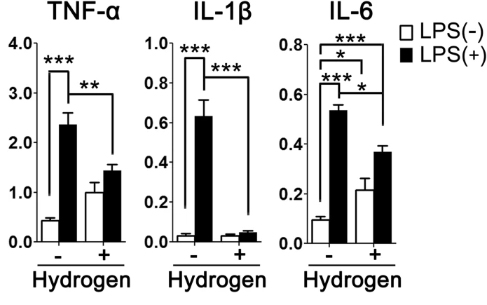
Imagen de cortesía – https://pubmed.ncbi.nlm.nih.gov/29907804/
Patrones de expresión genética alterados en astrocitos cultivados primarios del grupo control, el grupo LPS y el grupo HW + LPS.
Como se describió anteriormente, también se observaron el perfil de expresión génica de la microglía y los patrones diferenciales de expresión génica de los astrocitos de ratones recién nacidos en el grupo control, el grupo LPS y el grupo HW + LPS. Estos resultados sugieren que el H2 también podría influir en la función de la microglía y los astrocitos mediante cambios en la expresión genética.
Conclusión
En conclusión, se trata de un descubrimiento más importante sobre los efectos positivos de la administración de H2. Esta investigación ha proporcionado evidencia de que la administración materna de H2 atenúa los déficits en la memoria a corto plazo y la interacción social en el modelo MIA inducido por LPS y también ha demostrado una atenuación de la pérdida de células neuronales y oligodendrocíticas inducida por LPS. El efecto neuroprotector del H2 que apareció en la amígdala y la corteza en este modelo de ratón fue notable. La neuroprotección se debió a la represión de la neuroinflamación, incluida la activación excesiva de la microglía y los astrocitos y el aumento del nivel de citoquinas proinflamatorias.
Aunque se requiere más investigación, los resultados actuales muestran la eficacia potencial de la administración materna de H2 durante períodos más prolongados. También produce resultados neurológicos a largo plazo en la descendencia expuesta a inflamación en el útero.
En general, estos hallazgos indican que la administración materna de H2 ejerce efectos neuroprotectores y mejora los déficits de desarrollo neurológico de la descendencia inducidos por MIA en etapas posteriores de la vida.
Los humanos ya han comenzado a tomar H2 molecular mediante métodos. Y, hasta la fecha, no se ha informado de ningún caso de efectos secundarios de la administración molecular de H2.